こんにちは、「猫の額」の菜園・花壇にお越しいただきありがとうございます。
管理人の花都 野菜です。
菊の挿し木について、根は挿し穂のどこから生えてくるのかが気になって実験してみることにしました。私としては土中に挿すときに葉を下のほうから2枚ほど切り取ったこの部分が発根点だと思っていました。ところが、このブログを始めるにあたり、「挿し木の発根メカニズム」というキーワードでMicrosoft BingのCOPILOTで検索すると、一部抜粋ですが、以下の回答がありました。
「3.挿し木の生理
(1) カルス形成と発根
挿し穂の切断面において、傷を受けた細胞は傷害ホルモンともいわれるオーキシンを分泌し、茎の上部から転流される生長ホルモンとしてのオーキシンの作用によって癒傷組織ともいわれるカルスを形成する。カルスは形成層や師部から発達し、これによって挿し穂の切り口は病菌からある程度保護されるとともに、切口からの有用物質の流失も防がれる。
形成されたカルス内に通導組織(木部維管束)が分化し、茎の木部維管束と連絡すると同時に根原基(根の基)の分化が始まる。しかし、厳密にはカルス形成と根原基の形成とは無関係であり、カルスは切口の保護のためには必要であるが、発根過程においては必ずしも不可欠とはいえず、過度のカルス形成は発根を阻害することが多い。
根原基の分化は、形成層の細胞分裂に伴って形成され、基本的にはカルス形成とは無関係な現象といえるが、挿し木当初はカルス形成に伴って根原基が分化し、切断部位からの発根がみられるが、その後茎から直接根原基が分化し始める。根原基の分化は生長ホルモンのオーキシンによって促進され、発根促進剤として使われるオキシベロンはオーキシンの一種のインドール酪酸の製剤であり、ルートンはナフタレン酢酸アミドである。」
AI検索の結果はAI自体の学習結果に応じて日々更新されるでしょうから、同じキーワードで同一の検索結果が出てくる保証は致しかねますが、つまりは切り口から発根するという結論のようではありながらも必ずしもそうではないというように解釈しました。果たしてどうなのでしょうか?発根箇所が切口であればこれから先の挿し穂の切り方にも影響してくるとも思いますので、実験と観察をしてみようと思った次第であります。レポートはおおむね1週間に1回位の投稿になろうかと思います。随時更新という形になるでしょうが、よろしくお願いいたします。
実験・観察の準備
発根点がどこかということは、実際に挿し木の苗の中の植付けには使用しない苗(植付本数には限りがあるので)を崩してみれば分かることではありますが、ペットボトルのような透明容器の中で発根の様子を観察するのもまた一興と思い実験してみることにしました。



左の画像が切り取った挿し穂です。その挿し穂を100倍希釈のメネデール液に1昼夜吸水(中央の画像)させました。その挿し穂の先端が水面すれすれで水中に埋没しないようティッシュペーパーを巻き更にその上にガムテープを巻いたのが右側の画像です。
水分は挿し穂の茎を伝ってティッシュペーパーのところまで浸み込んでいます。土中にて水分の補給がなされているのと疑似的な環境になっていいるとは思います。とはいえ、屋外に出すのは7月半ばのこの時期にはペットボトル内の水が高温となる恐れがあります。そこで屋内にて実験しているために十分な光量が得られるかどうかという懸念はあるのですが、菊の挿し穂の再生能力はかなり高いので発根するところまではそれなりの実験成果が出るであろうと思っています。
7日目の様子(腐ることなく経過)
実験開始から今日(’24/07/21)で7日目、特に大きな変化はありません。実験開始直後に吸水処理させたメネデール100倍希釈液にそのまま浸して約3日、その後は希釈液が腐るとまずいので2日に1度ずつ水を取り替えています。その水は恐らくは1000倍以上に希釈した液肥を用いています。
懸念事項である日当たりの問題は、出来るだけ窓際で直射日光とはならない程度の日差しの当たる場所に置きました。この1週間は穂先が特にしおれるようなことも、また、培養水も腐るようなこともなく過ぎていきましたが、今から思えばもう少し涼しい時期4,5月頃に実験すれば良かったかなと思っています。
ビニールポットの挿し穂の様子(別口の挿し穂)
別の記事(菊の植付け’24)で菊の植付けについて投稿していますが、その際、植付けに使用しなかった菊苗の土を落として発根の様子を観察しました。

1ヶ月半ほど前にビニールポットに挿木しておいた菊の苗の内、植付に使用しなかった苗の発根の状態です。土を落とす際に土と一緒に細根が大分落ちてしまいましたが、それでも発根の様子は観察できました。六本の苗に共通しているのは、葉の付け根以外からも発根していることです。そして、一番左の苗は切り口からの発根は見られません。発根している箇所の最下部から切り口までの部分については、茶色く変色していて恐らく腐敗したものと思われます。右から数えて3番目までの苗については切り口付近からも発根しているのですが、挿し穂を作る際に葉の付け根が残るように切った可能性もあるため切り口からの発根であるとは断定することはできません。
この観察から明らかになったことは、挿し穂の発根は葉の付け根以外からも生じるということです。そして切り口からの発根は、現段階では否定も肯定も出来ないということです。
14日目の様子(もしかして発根?)

実験開始から14日目(’24/07/28)です。挿し穂の切り口を拡大してみました。画像内の上向き矢印で示した部分がなんとなく気になります。この部分がもしかすると根になるのかもしれません。とはいえ今のところ断定はできません。もう少し様子を見ていかなければならないでしょう。
21日目の様子(いよいよ発根!)
発根が確認できました。

右側の二本の赤矢印で示した箇所では明らかに発根しています。主根の他に根毛も確認できます。この発根箇所は葉を切り取った箇所よりも2cmくらいは下になります。また、この箇所より下の葉の付け根の部分のすぐ上で茎を切断したのでここは葉の付け根の部位ではありません。このことから少なくとも菊の場合、切り取った葉の付け根以外からも発根するということが確認されたと考えてよいでしょう。なお、この画像で示した2本の根以外も茎から生えた根がこの茎の裏側にあと1本は確認できていますので、現時点で少なくとも3本が茎の部分から発根しているということになります。
切り口からの発根については再左端の1本の赤矢印で示した箇所が今後根に成長していくかもしれません。この矢印で示したような白い塊が切り口のところに、茎の表面からほぼ等距離の内側のところに1列の環形に並んでいることがお分かりだと思います。先週の記事の画像ではこの白い塊の数はこれほど多くはなっていませんでした。
ここで思い起こしていただきたいことは、菊は双子葉植物だということです。ご存知のように双子葉植物の維管束は茎では表皮から一定の間隔をとって1列の環形に、即ち表皮も含めて同心円のように並んでいるということです。とすると、この切り口に1列の環形に並んだ白い塊はこの記事の導入部で触れたカルスが維管束の出口に形成されたものではないのかという気がしています。
この切り口の同心円状に並んだ白い塊を見るまでは、カルスというものは切り口全体を覆うように形成されるものとばかりに思っていました。尤もこれから先に白い塊がどんどんと生長していって切り口全体を覆うようになる可能性は否定できませんし、そもそもカルスではない別物という可能性も否定できません。なので、この実験及び観察はもう少し先まで続けたく思います。
28日目の様子(ぐんぐんと伸びていく根)

実験開始から28日目(’24/08/11)です。根がぐんぐんと伸長しているのがわかります。切り口のところからは発根の様子は見られず、また色も黒ずんできて腐敗し始めているのかとも思われる状態です。これから先根がどのように生長していくのか、果たして切り口からの発根は見られるのか、もう少し様子を見ることにします。
35日目の様子(根の本数増加!)

実験開始から35日目(’24/08/18)です。根の本数が増加しています。切り口からの発根は見られないのですが……。少々の変化が確認できました。下の画像は同じ日の切り口の様子です。

21日目の様子の段落で述べたカルスではないかと思われる白い塊が増加しているのが分ると思いますが、切り口のいたるところに出来ています。さらには切り口の少し上の茎の部分にも似たような白い塊が見て取れると思います。そこで、21日目の様子の段落で述べた維管束の出口にカルスが形成されるということについて、もしかすると維管束以外にもカルスが形成されるのかもしれないということと、あるいはそもそもカルスではない別物なのかもしれないという可能性もあり得ます。
いずれにせよこの白い塊そのものの正体については筆者の知識や力量では解明出来ないでしょうが、今後どのようになっていくのかについてはもう少し観察を続けていくことにします。
43日目の様子(生長と本数の増加)


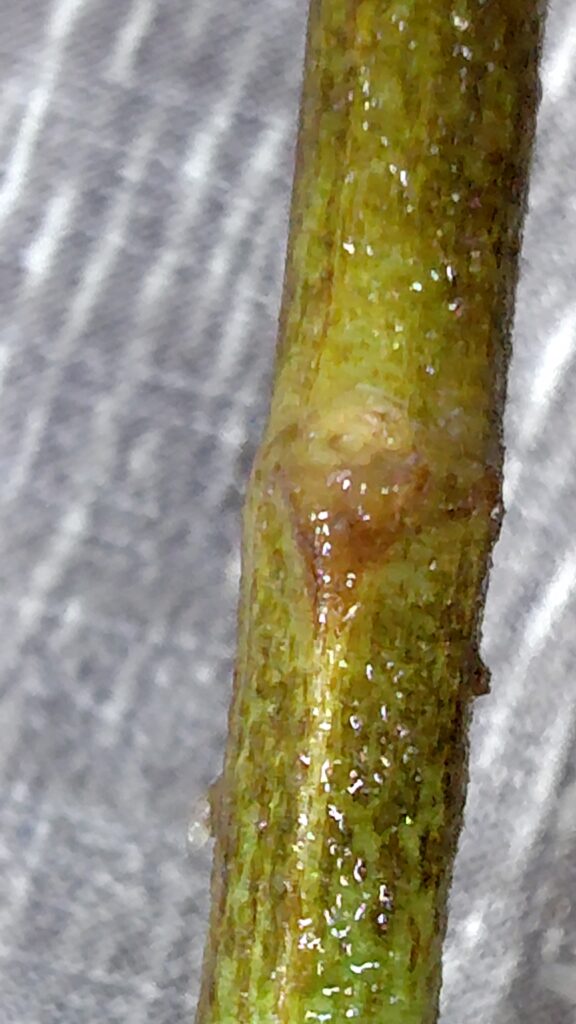
実験開始から43日目(24年8月26日)、根はぐんぐんと伸びて一番長いのは3㎝くらいになっています。左の画像の一番左の根がそれですが画像の中には納められませんでした。真ん中の画像は左の画像の裏側を撮影したものです。右の画像は切り落とした葉の付け根の部分です。御覧のように発根しておりません。
ここまでの経過で分かってきたのは葉の付け根からの発根は、どうやらなさそうだということと、切り口からの発根というよりは切口付近からの発根が顕著であるということです。このことはこの記事の中のビニールポットの挿し穂の様子(別口の挿し穂)使用した画像にても確認できそうです。その画像では発根部位が葉の付け根なのか切り口なのかがあまりはっきりとしていなかったのですが、今回の観察により切り口付近の茎から発根するという観点から改めて画像を見るとそのように発根していると決論付けられると思います。
但し、その段落の画像の中の一番左の挿し穂は発根部位の一番下のところが切り口から1cmほど上になっているのが少し気になります。この部分つまり切り口から1センチのところはもしかすると腐敗したのかもしれません。活着の良くない6本の挿し穂の中でも一番元気のない挿し穂でしたのでこの予想は当たらずといえども遠からず、ではないかと思っています。実験・観察の初めに挿し穂が下に落ちないようにとティッシュを茎にまいていたのは取り外しました。その部分から腐敗してしまう可能性が感じられたからです。
49日目の様子(根がさらに増加)

実験開始から49日目(“24年9月1日)の様子です。発根部位が切り口から少し上の方まで広がっているのが見て取れると思います。挿し穂を作る際に切り落とした2枚の葉の内の下の方から切り口に向かって3分の1位のところまで発根部位があります。一番長い根についてはその長さはほとんど変化がないようです。その代わりに他の根の長さが若干長くなったのと根の本数が増えたのかなと思います。ここまでの観察で少なくとも菊の場合には挿し木をする際に葉の付け根や切り口にはこだわらずに切り口から概ね4,5cm位を土に挿せばよいという結論に達しました。

以前の記事でも述べましたが、時々は培養液に液肥を入れるようにしています。液肥のキャップに培養液を入れた後、液は元に戻しキャップに水をいれてペットボトルに注いだ後に水を加えます。キャップの壁面等に残った液肥が恐らく千倍以上には希釈されるでしょう。
適切な濃度かどうかは何とも言えませんが、水道水のままよりは肥料の補充にはなるでしょう。その代わり培養水の交換には留意する必要があります。
この挿し穂についてはせっかくここまで生長したのでもう少し様子を見ることにします。今後果たして開花するまでになるのかどうか。それもまた楽しみのひとつとします。
56日目の様子(脇芽が出ている)

前回の画像の後の培養水は再び水道水にしました。
実験開始から56日目(’24年9月8日)の様子です。大きな変化は特に見られませんが、根が若干伸びたように思います。室内であることに加え肥料分が少ないことも影響しているのでしょうか。前回の画像でも同様だったのですが、よく見ると挿し穂の上部の葉の付け根から小枝が分岐しているのが見えます。挿し穂を採取した時にはこのような小枝はなかったので発根のみならず小枝の分も生長しているといえるでしょう。肥料分の投入も含めて今後の管理が重要です。次回投稿までには液肥の投入を行うつもりです。
63日目の様子(脇芽の生長)

大きな変化は見られませんが、小枝というか脇芽が少し生長したようです。
実験開始から63日目(’24年9月15日)の様子です。脇芽が少し生長したのとその色が新緑の言わば若草色とでもいうのでしょうか、淡い緑色です。液体肥料と時々窓際の日光に当てながら継続して観察を続けます。果たして開花するでしょうか。
70日目の様子(花芽?)

実験開始から70日目(’24年9月22日)の様子です。萎れています。4日ほど前に日光に当てようと1、2時間ほど日向に出しておいたのが災いしたのかもしれません。その時にペットボトルの中の水がぬるま湯のようになっていました。ひいき目ながら先端部に花芽のようなつぼみが出来たように思ったのですが、もしかするとこのまま最悪の事態を迎えることになるかもしれません。
77日目の様子

残念ながら、枯れてしまいました。日光にあてようと日向に出したのが失敗の原因だと思います。開花とまではいかなくとも、何とかして翌年の苗木にでもなってくれればと思っていたのですが……。
まとめ
挿し穂の発根がどこから発生するのか?学術的なことについては分かりかねますが、少なくとも菊の発根部位についてはそれなりの結論を得ることが出来たと思います。菊以外の挿し穂によって増えていく植物についての研究は機会を作れれば取り組みたいとは思います。どこまでできるかはなんとも言えません。何かアドバイスがありましたらよろしくご指導ください。
ここまでお付き合いいただきましてありがとうございました。またお会いできる日を楽しみにしております。



コメント